
Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Patogenesen av hepatitt B
Medisinsk ekspert av artikkelen
Sist anmeldt: 07.07.2025
I patogenesen til hepatitt B kan flere ledende ledd i den patogenetiske kjeden identifiseres:
- introduksjon av patogenet - infeksjon;
- fiksering på hepatocytten og penetrering inn i cellen;
- multiplikasjon av viruset og dets "utpressing" på overflaten av hepatocytten, så vel som inn i blodet;
- aktivering av immunologiske reaksjoner som tar sikte på å eliminere patogenet;
- skade på immunkomplekser i organer og systemer;
- dannelse av immunitet, frigjøring fra patogenet, gjenoppretting.
Siden infeksjon med hepatitt B alltid skjer parenteralt, kan man anta at infeksjonsøyeblikket praktisk talt tilsvarer virusets penetrering i blodet. Forsøk fra noen forskere på å skille enterale og regionale faser ved hepatitt B er dårlig underbygget. Det er mer grunn til å tro at viruset umiddelbart kommer inn i leveren med blodstrømmen.
Tropismen til hepatitt B-viruset til levervev er forhåndsbestemt av tilstedeværelsen av en spesiell reseptor i HBsAg - et polypeptid med en molekylvekt på 31 000 Da (P31), som har albuminbindende aktivitet. En lignende albuminsone finnes også på membranen til hepatocytter i leveren hos mennesker og sjimpanser, noe som i hovedsak bestemmer tropismen til HBV til leveren hos mennesker og sjimpanser.
Når viruset trenger inn i hepatocytten, frigjøres viralt DNA, som, når det kommer inn i hepatocyttkjernen og fungerer som en matrise for syntesen av nukleinsyrer, utløser en serie sekvensielle biologiske reaksjoner, hvis resultat er montering av virusets nukleokapsidet. Nukleokapsidet migrerer gjennom kjernemembranen inn i cytoplasmaet, hvor den endelige monteringen av Dane-partikler - det komplette hepatitt B-viruset - finner sted.
Det skal imidlertid bemerkes at når en hepatocytt blir infisert, kan prosessen forløpe på to måter - replikativ og integrerende. I det første tilfellet utvikles et bilde av akutt eller kronisk hepatitt, og i det andre - virusbærer.
Årsakene som bestemmer de to typene interaksjon mellom viralt DNA og hepatocytter er ikke presist fastslått. Mest sannsynlig er responstypen genetisk bestemt.
Resultatet av replikativ interaksjon er montering av kjerneantigenstrukturene (i kjernen) og montering av det komplette viruset (i cytoplasmaet), etterfulgt av presentasjon av det komplette viruset eller dets antigener på membranen eller i strukturen til hepatocyttmembranen.
Det er generelt akseptert at virusreplikasjon ikke resulterer i celleskade på hepatocyttnivå, siden hepatitt B-viruset ikke har en cytopatisk effekt. Denne posisjonen kan ikke anses som udiskutabel, siden den er basert på eksperimentelle data som, selv om de indikerer fravær av en cytopatisk effekt av hepatitt B-viruset, ble innhentet på vevskulturer og derfor ikke fullt ut kan ekstrapoleres til viral hepatitt B hos mennesker. Uansett krever spørsmålet om fravær av hepatocyttskade i løpet av replikasjonsfasen ytterligere studier.
Uansett arten av virusets interaksjon med cellen, er leveren nødvendigvis involvert i den immunopatologiske prosessen. I dette tilfellet er skaden på hepatocytter forbundet med det faktum at som et resultat av uttrykket av virale antigener på hepatocyttmembranen og frigjøringen av virale antigener i fri sirkulasjon, er en kjede av sekvensielle cellulære og humorale immunreaksjoner inkludert, som til slutt tar sikte på å fjerne viruset fra kroppen. Denne prosessen utføres i full overensstemmelse med de generelle mønstrene for immunresponsen på virusinfeksjoner. For å eliminere patogenet er cellulære cytotoksiske reaksjoner inkludert, mediert av ulike klasser av effektorceller: K-celler, T-celler, naturlige drepere, makrofager. Under disse reaksjonene ødelegges de infiserte hepatocyttene, noe som er ledsaget av frigjøring av virale antigener (HBcAg, HBeAg, HBsAg), som utløser antistoffgenesesystemet, som et resultat av at spesifikke antistoffer akkumuleres i blodet, primært mot kjernen - anti-HBc og e-antigen - anti-HBE. Følgelig skjer frigjøringen av levercellen fra viruset i prosessen med dens død på grunn av reaksjonene av cellulær cytolyse.
Samtidig binder spesifikke antistoffer som akkumuleres i blodet seg til virusantigenene, og danner immunkomplekser som fagocytiseres av makrofager og skilles ut av nyrene. I dette tilfellet kan forskjellige immunkomplekslesjoner oppstå i form av glomerulonefritt, arteritt, artralgi, hudutslett, etc. Med deltakelse av spesifikke antistoffer renses kroppen for patogenet, og fullstendig bedring skjer.
I samsvar med det skisserte konseptet om patogenesen til hepatitt B, forklares vanligvis hele mangfoldet av kliniske varianter av sykdomsforløpet av særegenheter ved virusets interaksjon og samarbeidet mellom immunkompetente celler, med andre ord, styrken til immunresponsen på tilstedeværelsen av virale antigener. I følge moderne konsepter er styrken til immunresponsen genetisk bestemt og knyttet til histokompatibilitetsantigenene til HLA-lokuset av første klasse.
Det er generelt akseptert at under tilstrekkelig immunrespons på virusantigener utvikler akutt hepatitt seg klinisk med et syklisk forløp og fullstendig bedring. Mot bakgrunnen av en reduksjon i immunresponsen på virusantigener, uttrykkes immunmediert cytolyse ubetydelig, derfor er det ingen effektiv eliminering av infiserte leverceller, noe som fører til milde kliniske manifestasjoner med langvarig persistens av viruset og muligens utvikling av kronisk hepatitt. Samtidig, tvert imot, i tilfelle av en genetisk bestemt sterk immunrespons og massiv infeksjon (hemotransfusjon), oppstår det omfattende områder med levercelleskade, som klinisk tilsvarer alvorlige og ondartede former av sykdommen.
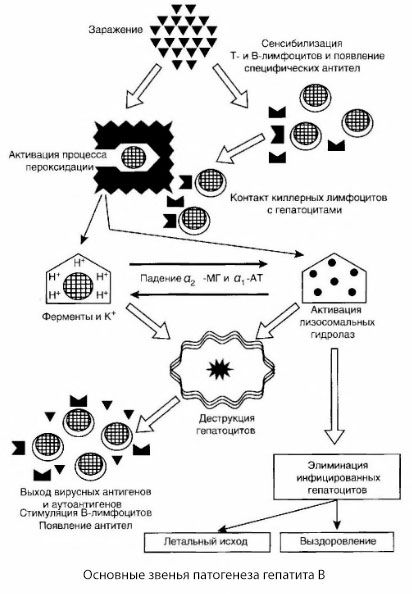
Den presenterte ordningen for patogenesen av hepatitt B utmerker seg ved sin sammenheng; den inneholder imidlertid en rekke kontroversielle og dårlig studerte punkter.
Hvis vi følger konseptet om hepatitt B som en immunopatologisk sykdom, kan vi forvente en økning i cellulære cytotoksisitetsreaksjoner med økende alvorlighetsgrad av sykdommen. I alvorlige former reduseres imidlertid indeksene for den cellulære immunitetskoblingen kraftig, inkludert et flertallsfall, sammenlignet med friske barn, og K-celle cytotoksisitetsindeksen. I den ondartede formen, i perioden med utvikling av massiv levernekrose og spesielt leverkoma, observeres en fullstendig manglende evne hos lymfocytter til å fullføre transformasjon under påvirkning av fytohemattlutinin, stafylokokkendotoksin og HBsAg. I tillegg er det ingen evne hos leukocytter til å migrere i henhold til leukocyttmigrasjonsinhiberingsreaksjonen (LMIC), og en kraftig økning i permeabiliteten til lymfocyttmembraner avsløres i henhold til resultatene av deres studier ved bruk av en fluorescerende tetracyklinprobe.
Hvis fluorescensindeksene for lymfocytter hos friske personer er 9,9 ± 2 %, og ved typisk hepatitt B med godartet forløp øker de til 22,3 ± 2,7 %, når antallet fluorescerende lymfocytter i gjennomsnitt 63,5 ± 5,8 %. Siden en økning i permeabiliteten til cellemembraner entydig vurderes i litteraturen som en pålitelig indikator på deres funksjonelle underlegenhet, kan det konkluderes med at ved hepatitt B, spesielt i den ondartede formen, er det grov skade på lymfocyttene. Dette fremgår også av indeksene for K-celle-cytotoksisitet. I en alvorlig form, i den 1.-2. uken av sykdommen, er cytotoksisiteten 15,5 ± 8,8 %, og i den ondartede formen i den 1. uken - 6,0 ± 2,6, i den 2. - 22,0 ± 6,3 % med en norm på 44,8 ± 2,6 %.
De presenterte dataene indikerer tydelig uttalte forstyrrelser i den cellulære koblingen til immunitet hos pasienter med alvorlige former for hepatitt B. Det er også åpenbart at disse endringene oppstår sekundært, som et resultat av skade på immunkompetente celler av giftige metabolitter og muligens sirkulerende immunkomplekser.
Studier har vist at hos pasienter med alvorlige former for hepatitt B, spesielt ved utvikling av massiv levernekrose, reduseres titeren av HBsAg og HBeAg i blodserumet, og samtidig begynner antistoffer mot overflateantigenet å bli oppdaget i høye titere, noe som er helt ukarakteristisk for godartede former av sykdommen, der anti-HBV bare vises i 3.-5. måned av sykdommen.
Den raske forsvinningen av hepatitt B-virusantigener med samtidig forekomst av høye titere av antivirale antistoffer antyder intensiv dannelse av immunkomplekser og deres mulige deltakelse i patogenesen av utviklingen av massiv levernekrose.
Dermed tillater ikke faktamaterialet oss å tolke hepatitt B entydig kun fra et immunopatologisk aggresjonsperspektiv. Og poenget er ikke bare at det ikke finnes noen sammenheng mellom dybden og forekomsten av morfologiske endringer i leveren på den ene siden og alvorlighetsgraden av cellulære immunitetsfaktorer på den andre. Teoretisk sett kan denne omstendigheten forklares med de sene stadiene i studiet av cellulære immunitetsindikatorer, da immunkompetente celler ble utsatt for kraftige toksiske effekter på grunn av økende funksjonell insuffisiens i leveren. Det kan selvfølgelig antas at immuncytolyse av hepatocytter forekommer i de tidligste stadiene av den infeksjonsmessige prosessen, muligens til og med før kliniske symptomer på alvorlig leverskade oppstår. En slik antagelse er imidlertid usannsynlig, siden lignende indikatorer på cellulær immunitet ble oppdaget hos pasienter med det mest akutte (lynnende) sykdomsforløpet, og i tillegg ble det ikke oppdaget massiv lymfocyttinfiltrasjon under morfologisk undersøkelse av levervev, samtidig som det ble oppdaget kontinuerlige felt av nekrotisk epitel uten fenomenene resorpsjon og lymfocyttisk aggresjon.
Det er svært vanskelig å forklare det morfologiske bildet av akutt hepatitt kun fra immuncellulær cytolyse, derfor ble den cytotoksiske effekten av hepatitt B-viruset ikke utelukket i tidlige studier.
For tiden er denne antagelsen delvis bekreftet av oppdagelsen av hepatitt B-viruset. Studier har vist at hyppigheten av påvisning av hepatitt D-markører er direkte avhengig av sykdommens alvorlighetsgrad: i milde former oppdages de hos 14 %, moderate - hos 18 %, alvorlige - hos 30 % og ondartede - hos 52 % av pasientene. Tatt i betraktning at hepatitt D-viruset har en nekrosogen cytopatisk effekt, kan det anses som fastslått at koinfeksjon med hepatitt B- og D-virus er av stor betydning i utviklingen av fulminante former for hepatitt B.
Patogenesen til hepatitt B kan presenteres som følger. Etter at hepatitt B-viruset har penetrert hepatocytter, induseres et immunologisk angrep på de infiserte hepatocyttene av T-killere, som utskiller lymfotoksiner i retning av leverceller.
De intime mekanismene for leverskade ved hepatitt B er ennå ikke fastslått. Den ledende rollen spilles av aktiverte prosesser med lipidperoksidasjon og lysosomale hydrolaser. Utløsende faktor kan være lymfotoksiner som frigjøres fra effektorceller ved kontakt med hepatocytter, men det er mulig at viruset selv kan være initiatoren for peroksidasjonsprosesser. Deretter utvikler den patologiske prosessen seg mest sannsynlig i følgende rekkefølge.
- Interaksjon mellom aggresjonsfaktoren (lymfotoksiner eller virus) og biologiske makromolekyler (muligens med komponenter i endoplasmatisk retikulum-membraner som er i stand til å delta i avgiftningsprosesser, analogt med andre skadelige stoffer, slik det ble vist i forbindelse med karbontetraklorid).
- Dannelse av frie radikaler, aktivering av lipidperoksidasjonsprosesser og økt permeabilitet av alle hepatocellulære membraner (cytolysesyndrom).
- Bevegelse av biologisk aktive stoffer langs konsentrasjonsgradienten - tap av enzymer fra forskjellige intracellulære lokaliseringer, energidonorer, kalium, etc. Akkumulering av natrium og kalsium i celler, endring i pH mot intracellulær acidose.
- Aktivering og frigjøring av lysosomale hydrolaser (RNAse, DNAse, katepsiner, etc.) med nedbrytning av leverceller og frigjøring av autoantigener.
- Stimulering av T- og B-immunsystemene med dannelse av spesifikk sensibilisering av T-lymfocytter til leverlipoprotein, samt dannelse av antihepatiske humorale autoantistoffer.
I den foreslåtte ordningen for hepatitt B-patogenese er den utløsende faktoren virale antigener, hvis intensive produksjon observeres i de tidligste stadiene av sykdommen og gjennom hele den akutte perioden, med unntak av ondartede former, der produksjonen av virale antigener praktisk talt opphører ved utvikling av massiv levernekrose, noe som forutbestemmer en rask reduksjon i virusreplikasjon.
Det er også åpenbart at virale antigener aktiverer T- og B-systemene i immuniteten. Under denne prosessen skjer en karakteristisk omfordeling av T-lymfocytt-subpopulasjoner, med sikte på å organisere en tilstrekkelig immunrespons, eliminere infiserte hepatocytter, nøytralisere virale antigener, sanogenese og gjenoppretting.
Når immunkompetente celler interagerer med virale antigener på hepatocytmembraner eller under virusreproduksjon inne i en hepatocytt, oppstår det betingelser for aktivering av lipidperoksidasjonsprosesser, som, som kjent, kontrollerer permeabiliteten til alle cellulære og subcellulære membraner.
Fra denne posisjonen blir forekomsten av cytolysesyndrom, en økt permeabilitet av cellemembraner, som er så naturlig og svært karakteristisk for viral hepatitt, forståelig.
Det endelige utfallet av cytolysesyndrom kan være fullstendig frakobling av oksidativ fosforylering, lekkasje av cellulært materiale og død av leverparenkymet.
I de aller fleste tilfeller utvikler disse prosessene seg imidlertid ikke så fatalt. Bare i ondartede former av sykdommen forløper den patologiske prosessen skredlignende og irreversibelt, ettersom det oppstår massiv infeksjon, en uttalt immunprosess, overdreven aktivering av peroksidasjonsprosesser og lysosomale hydrodaser, samt autoimmune aggresjonsfenomener.
De samme mekanismene observeres ved gunstig forløp av hepatitt B, med den eneste særegenheten at de alle realiseres på et kvalitativt forskjellig nivå. I motsetning til tilfeller av massiv levernekrose, er antallet infiserte hepatocytter, og dermed sonen for immunopatologisk cytolyse, mindre ved gunstig sykdomsforløp. Prosessene med lipidperoksidasjon er ikke like signifikant forbedret. Aktiveringen av syrehydrolaser fører kun til begrenset autolyse med en ubetydelig frigjøring av autoantigener, og derfor, uten massiv autoaggresjon, det vil si at alle stadier av patogenesen ved gunstig forløp utføres innenfor rammen av den bevarte strukturelle organiseringen av leverparenkymet og begrenses av forsvarssystemer (antioksidanter, inhibitorer, etc.) og har derfor ikke en så destruktiv effekt.
Årsakene til russymptomer ved viral hepatitt er ikke fullt ut studert. Forslaget om å skille mellom såkalt primær, eller viral, rus og sekundær (utveksling eller metabolsk) kan anses som positivt, selv om dette ikke avslører den intime mekanismen for forekomsten av generelt toksisk syndrom. For det første har hepatittvirus ikke toksiske egenskaper, og for det andre korrelerer ikke konsentrasjonen av mange metabolitter alltid med alvorlighetsgraden av sykdommen og graden av uttrykk av toksikosymptomer. Det er også kjent at konsentrasjonen av virale antigener ikke strengt korrelerer med alvorlighetsgraden av rus. Tvert imot, med en økning i alvorlighetsgraden av sykdommen, og dermed økningen i graden av toksikose, synker konsentrasjonen av HBsAg og er lavest i ondartede former ved tidspunktet for utbruddet av dyp leverkoma. Samtidig avhenger deteksjonsfrekvensen og titrene av spesifikke antivirale antistoffer direkte av alvorlighetsgraden av sykdommen.
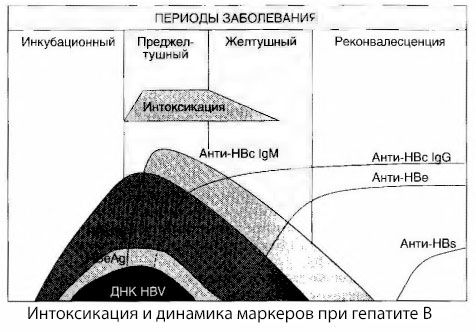
Forgiftning oppstår ikke i det øyeblikket virale antigener registreres, men i løpet av sirkulasjonsperioden i blodet av antivirale antistoffer av klasse IgM mot ku-antigenet og antigenet til E-systemet. Dessuten har en betydelig andel pasienter i alvorlige og spesielt ondartede former til og med anti-HB i blodet, noe som vanligvis aldri observeres i milde og moderate former av sykdommen.
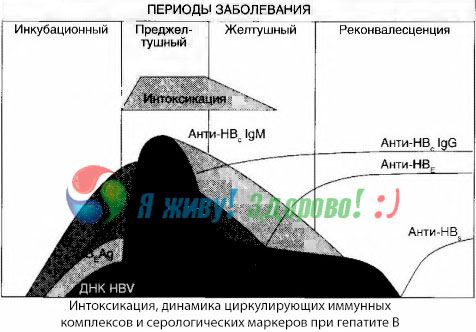
De presenterte dataene lar oss konkludere med at toksikosesyndromet ved viral hepatitt, og spesielt hepatitt B, ikke oppstår som et resultat av forekomsten av virale antigener i blodet, men er en konsekvens av interaksjonen mellom virale antigener og antivirale antistoffer av IgM-klassen. Resultatet av slik interaksjon er, som kjent, dannelsen av immunkomplekser og muligens aktive giftstoffer.
Symptomer på rusmiddel oppstår i det øyeblikket immunkomplekser oppstår i fri sirkulasjon, men senere observeres ikke en slik korrelasjon.
En delvis forklaring på dette kan finnes i studiet av sammensetningen av immunkomplekser. Hos pasienter med alvorlige former sirkulerer hovedsakelig mellomstore komplekser i blodet, og i deres sammensetning, på høyden av det toksiske syndromet, dominerer antistoffer av klassen, mens i perioden med nedgang i kliniske manifestasjoner og rekonvalesens blir kompleksene større, og i deres sammensetning begynner antistoffer av IgG-klassen å dominere.
De presenterte dataene gjelder mekanismene for utvikling av toksisk syndrom i sykdommens innledende periode, men ved toksisose som oppstår på høyden av kliniske manifestasjoner, har de bare delvis betydning, og spesielt ved utvikling av leverkoma.
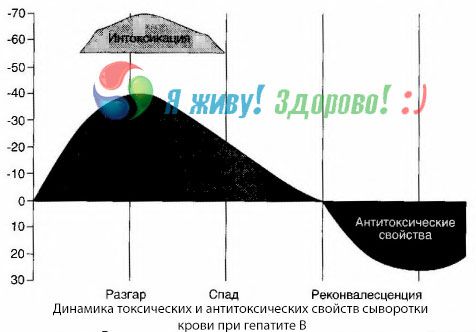
Blodkulturmetoden har vist at ved hepatitt B samler det seg stadig opp giftstoffer i blodet, frigjort fra skadet, forråtnende levervev. Konsentrasjonen av disse giftstoffene er proporsjonal med alvorlighetsgraden av sykdommen, de er av proteinisk natur.
I løpet av rekonvalesensperioden vises antistoffer mot dette toksinet i blodet; men i tilfelle leverkoma øker konsentrasjonen av toksinet i blodet kraftig, og antistoffer oppdages ikke i blodet.
Patomorfologi av hepatitt B
Basert på arten av morfologiske endringer, skilles det mellom tre former for akutt hepatitt B:
- syklisk form,
- massiv levernekrose;
- kolestatisk pericholangiolytisk hepatitt.
Ved den sykliske formen av hepatitt B er dystrofiske, inflammatoriske og proliferative forandringer mer uttalt i midten av lobulene, mens de ved hepatitt A er lokalisert langs periferien av lobulen og sprer seg til midten. Disse forskjellene forklares av ulike veier for viruspenetrasjon inn i leverparenkymet. Hepatitt A-viruset kommer inn i leveren gjennom portvenen og sprer seg til midten av lobulene, mens hepatitt B-viruset trenger inn gjennom leverarterien og kapillærgrenene som forsyner alle lobulene jevnt, helt opp til midten.
Graden av skade på leverparenkym tilsvarer i de fleste tilfeller alvorlighetsgraden av sykdommens kliniske manifestasjoner. I milde former observeres vanligvis fokal nekrose av hepatocytter, og i moderate og alvorlige former - zonal nekrose (med en tendens til å slå seg sammen og danne brolignende nekrose i alvorlige former av sykdommen).
De største morfologiske endringene i parenkymet observeres på høydepunktet av kliniske manifestasjoner, som vanligvis sammenfaller med sykdommens første tiår. I løpet av det andre og spesielt det tredje tiåret intensiveres regenereringsprosessene. I denne perioden forsvinner nekrobiotiske endringer nesten fullstendig, og cellulære infiltrasjonsprosesser begynner å dominere med langsom påfølgende gjenoppretting av strukturen til de hepatocellulære platene. Fullstendig gjenoppretting av strukturen og funksjonen til leverparenkymet skjer imidlertid bare 3–6 måneder etter sykdomsdebut, og ikke hos alle pasienter.
Den generaliserte naturen til infeksjonen ved hepatitt B bekreftes ved påvisning av HBsAg ikke bare i hepatocytter, men også i nyrer, lunger, milt, bukspyttkjertel, benmargsceller, etc.
Kolestatisk (perikolangiolytisk) hepatitt er en spesiell form for sykdommen, der de største morfologiske endringene finnes i de intrahepatiske gallegangene, med et bilde av kolangiolitt og perikolangiolitt. I den kolestatiske formen oppstår kolestase med utvidelse av gallekapillærene med stase av galle i dem, med proliferasjon av kolangiole og cellulære infiltrater rundt dem. Levercellene påvirkes ubetydelig i denne formen for hepatitt. Klinisk er sykdommen preget av et langvarig forløp med langvarig gulsott. Det har blitt vist at årsaken til et slikt særegent sykdomsforløp er virusets dominerende effekt på kolangioleveggene med en ubetydelig effekt på hepatocytter.

