
Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Hvordan et embryo «biter» seg inn i morsvevet: implantasjonsmekanikken hos mennesker filmet i sanntid for første gang
Sist anmeldt: 23.08.2025
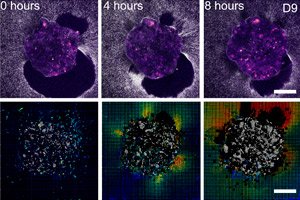 ">
">Forskere fra Barcelona (IBEC, Dexeus Mujer) og Tel Aviv har for første gang i sanntid og i 3D vist hvordan et menneskelig embryo fester seg til «livmorstillaset» og bokstavelig talt trekker og omstrukturerer det omkringliggende vevet. For å gjøre dette laget de en deformerbar ex vivo-plattform (kollagen/ECM-geler) og brukte trekkraftmikroskopi direkte på levende menneske- og museembryoer. Hovedfunnet: kraftmønsteret er artsspesifikt, og embryoene i seg selv er mekanosensitive: de reagerer på eksterne mekaniske signaler ved å omstrukturere cytoskjelettet og endre vekstretningen.
Bakgrunn for studien
Implantasjon er «flaskehalsen» i menneskelig reproduksjon: det er på dette stadiet at både naturlig unnfangelse og IVF-forsøk oftest mislykkes. Samtidig er menneskelig implantasjon interstitiell: embryoet «fester seg» ikke bare, men er fullstendig innebygd i endometriet – en biokjemisk og mekanisk kompleks prosess, men inntil nylig nesten ikke observert i levende systemer hos mennesker. Derfor forble mekanikken for adhesjon og invasjon en «svart boks», og konklusjoner ble ofte trukket basert på indirekte markører eller data fra dyremodeller.
Klassisk implantasjonsbiologi har i stor grad vært avhengig av mus, men det er grunnleggende forskjeller mellom arter, fra blastocystorientering til implantasjonsdybde og mønster av cellulære krefter. Hos mus er implantasjon mer «overfladisk», med foretrukne retninger for vevsforskyvning; hos mennesker er den tydelig invasiv, med multifokale trekkrefter rundt embryoet. Disse forskjellene antyder at musemodellen ikke alltid skalerer til mennesker, spesielt når det gjelder mekanikk. Direkte observasjoner av det menneskelige embryoet i et deformerbart miljø var nødvendig.
Det teknologiske gjennombruddet ble muliggjort ved å kombinere deformerbare 2D/3D-matriser (kollagen/ECM) og trekkraftmikroskopi med langtids høyfrekvent avbildning. Denne «kunstige livmoren» gjorde det mulig å bokstavelig talt se og måle hvordan embryoet trekker, omstrukturerer og «borer» det omkringliggende vevet – og hvordan det reagerer på eksterne mekaniske signaler (mekanosensitivitet). Dette åpner veien for nye kriterier for å vurdere implantasjonspotensial og for å finjustere betingelsene for embryooverføring.
Konteksten anvendes: hvis miljøets mekaniske egenskaper og mønsteret av embryonale krefter er assosiert med hvor vellykket implantasjonen er, er det i IVF mulig å målrettet velge stivheten/sammensetningen av matrisen, ta hensyn til tidsvinduene for overføring, og til og med bruke "kraft"-målinger som en ekstra seleksjonsmarkør. Parallelt vil slike plattformer bidra til å forklare andelen tidlige svangerskapstap, når biokjemien er "normal", men mekanikken for adhesjon ikke er det. Alt dette gjør direkte 3D-observasjoner av menneskelig implantasjon ikke bare til en vakker video, men et nytt verktøy for reproduksjonsmedisin.
Hvorfor er dette viktig?
Implantasjonssvikt er en av hovedårsakene til infertilitet og opptil 60 % av spontanaborter. Til tross for biokjemiske fremskritt innen IVF, forble mekanikken i denne prosessen hos mennesker en «svart boks». En ny tilnærming lar oss se kreftene og banene ved embryoimplantasjon og gir et grunnlag for å forbedre embryovalg og overføringsforhold.
Hvordan det ble gjort
Forskerne satte sammen en «kunstig livmor» – et mykt, gjennomsiktig og deformerbart miljø der en vevslignende matrise synlig forskyves under påvirkning av embryonale krefter. Deretter fulgte kontinuerlig mikroskopi og beregningsanalyse av fiberforskyvningene.
- 2D- og 3D-plattformer: I 3D blir embryoet umiddelbart innebygd i matrisen (festestadiet «forbigås»), noe som gjør at man kan se boringen inn i vevets tykkelse.
- Høy "overlevelse og penetrasjon" i 3D: omtrent 80 % vellykket invasjon (begrenset av nærhet til glass).
- Trekkkart og digital volumkorrelasjon viser amplituder og retninger av forskyvninger rundt embryoet – i hovedsak en «utskrift» av kraft over tid.
Hva som ble funnet (kort og punkt for punkt)
1) Artsspesifikk mekanikk for implantasjon
- Menneske: embryoet settes inn i matrisen, og skaper flere trekkraftfokus og danner radielt ensartede forskyvninger rundt seg selv; invasjonsdybden er opptil 200 µm.
- Mus: embryoet sprer seg hovedsakelig over overflaten med uttalte prinsipielle forskyvningsretninger.
2) Embryoet sanser miljøets mekanikk
- Eksterne krefter → svar: i det menneskelige embryoet - rekruttering av myosin og rettet cellepseudopodi; i mus - rotasjon av implantasjons-/vekstaksen mot kilden til den eksterne kraften (orientering av PD-aksen).
- Mekanosensitive markører: hos mus, endringer i YAP-lokalisering i trofoblast; sammen indikerer dette en mekanosensitiv tilbakekoblingskrets.
3) Forholdet mellom styrke og vellykket implantasjon
- Mindre kollagenforskyvning → dårligere implantasjonsfremgang i menneskelige embryoer.
- Integriner – styrkekoblingen: RGD-peptidblokkering/Src-hemming hos mus reduserer implantasjonsdybde/-areal.
Hvordan ser implementeringen ut?
- På 2D- og 3D-plattformer dannes det en voksende «glorie» av fiberforskyvninger rundt embryoet; trekkraftkartet pulserer som om embryoet «skanner» omgivelsene sine.
- På glass danner det menneskelige embryoet en flat utvekst, men i en myk matrise forblir det mer sfærisk og går dypere – som i levende vev.
Hva gir dette til praksis (utsikter for IVF og ikke bare)
Ideen er enkel: implantasjon er ikke bare «reseptorkjemi», men også mekanikken bak adhesjon og trekkraft. Dette betyr at vi kan optimalisere:
- Materialer og medium hardhet under kultur-/implantasjonspotensialtester;
- Nye markører for embryoseleksjon – basert på baner og amplitude av forskyvninger i den «smarte» matrisen;
- Livmortrening/modulering (f.eks. gjennom skånsomme mekaniske signaler) for å forbedre adhesjon uten aggressive inngrep.
Forsiktig: ex vivo-arbeid foregår ikke «inne i livmoren». Men selve det faktum at et eksternt mekanisk signal endrer implantasjonsretningen/organiseringen av aksene åpner veien for personlige forhold for embryooverføring.
Restriksjoner
- Ex vivo-modellen tar ikke hensyn til immun-, hormon- og vaskulærdynamikken i det virkelige endometriet;
- Matrigel/kollagen definerer et sett med egenskaper (stivhet, viskoelastisitet, sammensetning), det er vanskelig å endre dem med én parameter;
- Etiske begrensninger for studier på mennesker (opptil 14 dagers vindu) begrenser langtidsobservasjon. Imidlertid øker den høye samsvaren med kjente implantasjonsmoduser in vivo (interstitiell hos mennesker vs. overfladisk hos mus) tilliten til modellen.
Konklusjon
Det menneskelige embryoet «trekker» og «borer» seg aktivt inn i morsvevet, og mekaniske signaler fra omgivelsene kan omkonfigurere dets oppførsel. Kraftmønsteret og implantasjonsstrategien er forskjellig hos mennesker og mus – og dette kan forklare hvorfor musemodellen ikke alltid forutsier vellykket implantasjon hos mennesker. Mekanikk er nå en fullverdig aktør innen tidlig embryologi og reproduksjonsmedisin.
Kilde: Godeau AL et al. Trekkraft og mekanosensitivitet medierer artsspesifikke implantasjonsmønstre i menneske- og museembryoer. Science Advances 11(33): eadr5199 (15. august 2025). DOI: 10.1126/sciadv.adr519
