
Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Studien understreker behovet for celletype-spesifikke behandlingsformer for hiv
Sist anmeldt: 02.07.2025
Forskere ved University of Illinois har vist viktigheten av å målrette spesifikke celletyper i behandlingen av HIV. Studien deres, publisert i tidsskriftet Proceedings of the National Academy of Sciences, er en av de første som ser på de differensielle eller celletypespesifikke effektene av HIV-latensmodulering på myeloide celler, en type immuncelle produsert i benmargen.
En av de største hindringene for å eliminere HIV-infeksjon er å håndtere latens, eller perioden hvor en infisert celle ligger i dvale og ikke kan produsere virus. Latente HIV-celler samler seg i kroppen på steder kjent som reservoarer. Latente reservoarer er problematiske fordi de kan begynne å produsere virus når som helst.
Fullstendig utryddelse av sykdommen ville kreve fjerning av alle latente celler fra kroppen eller permanent motstand mot aktiveringsstimuli. Reaktivering kan imidlertid utløses av en rekke faktorer, inkludert signaler som styrer differensiering av myeloidceller.
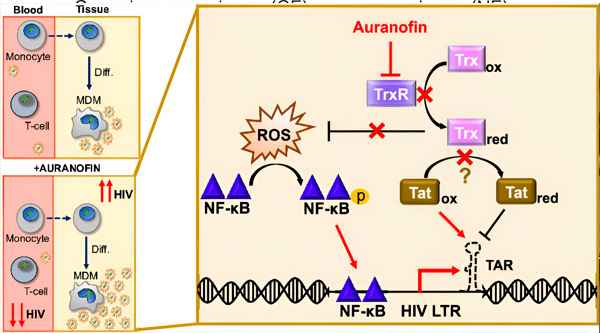
Regulering av HIV-latens i monocytt-avledede makrofager (MDM-er) kan utgjøre en risiko for virusspredning. Differensiering av monocytter til makrofager kan utløse HIV-reaktivering, noe som potensielt fremmer virusspredning i vev (øverst til venstre). En klinisk kandidat, Auranofin, reduserer viralt DNA i blod og fremmer HIV-latens i T-celler og monocytter, men forårsaker HIV-reaktivering i MDM-er (nederst til venstre). I MDM-er antar vi at hemming av TrxR av Auranofin fører til akkumulering av reaktive oksygenarter (ROS), som induserer NF-κB-aktivering og aktivering av HIV LTR-promotoren (høyre). Hemming av TrxR reduserer potensielt substratreduksjon, slik at Tat-proteinet forblir fortrinnsvis oksidert, hvor det kan binde seg til TAR og starte HIV-transkripsjon. Kilde: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
I årevis har forskning på HIV-kurering fokusert på to tilnærminger kjent som «sjokk og drep» og «blokk og lås». Førstnevnte fungerer i kombinasjon med antiretroviral terapi for å aktivere latent infiserte celler og drepe dem gjennom apoptose, eller programmert celledød, mens sistnevnte tvinger infiserte celler inn i en dyp latent tilstand som de ikke kan reaktivere fra på egenhånd.
Forskning rundt disse teknikkene har tradisjonelt fokusert på en type hvite blodlegemer kalt T-celler, som er det primære målet for HIV-infeksjon. Latente reservoarer består imidlertid av mer enn bare T-celler; faktisk inneholder de dusinvis av forskjellige celletyper, hver med sine egne unike mønstre av HIV-genuttrykk.
«Det finnes et enormt mangfold av celler, selv innenfor én enkelt cellelinje», sa Collin Kieffer, assisterende professor i mikrobiologi og en av forfatterne av artikkelen. «Variabiliteten i responsen i disse reservoarene øker med hver ny celletype.»
Alexandra Blanco, en masterstudent i Kieffers laboratorium, ønsket å studere celletyper som hadde blitt oversett i tradisjonell HIV-forskning. Med fokus på myeloide celler laget hun et klonbibliotek som inneholdt 70 populasjoner av latent infiserte monocytter. Blanco analyserte deretter de klonale populasjonene og deres responser på aktivering. Responsene varierte mye, noe som fremhever det store mangfoldet innenfor en enkelt celletype.
Denne observasjonen reiste et nytt spørsmål: reagerer ulike celletyper virkelig ulikt på HIV-latensbehandlinger? Funnene deres viste faktisk at noen HIV-latensbehandlinger kan fremme latens i T-celler og monocytter, mens de kan reversere latens i makrofager.
«Ikke alle celler i kroppen er like», sa Kieffer. «Så det er fornuftig at ikke alle infiserte celler vil reagere på viruset på samme måte.»
Deres artikkel fremhever behovet for at fremtidige HIV-behandlinger vurderer alle celletyper og hvordan hver celle kan reagere på potensielle terapier.
Funnene deres bygger på forskning av Roy Dar, en tidligere professor i bioingeniørfag i Illinois, hvis laboratorium studerte heterogenitet i HIV-genuttrykk.
«Han startet det, og vi tok det over og bygde det opp til der det er i dag», sa Kieffer. «Så samarbeidet satte virkelig fart på disse resultatene. Det har gitt laboratoriet vårt en ny retning, og vi er veldig begeistret for det.»
Et ytterligere og uventet funn fra Blancos analyse avdekket endringer i cellestørrelse og -form som respons på infeksjon, noe som tyder på at HIV kan endre cellemorfologi. Blancos neste mål er å identifisere de biologiske mekanismene som ligger til grunn for disse fenotypiske endringene.
Kieffer og hans laboratoriemedlemmer ser også frem til å gjenskape resultatene sine, som stort sett ble gjort i en cellelinje, i primærceller. Å gjenskape resultatene i en mer menneskelignende modell ville forbedre studiens kliniske relevans, forklarte Kieffer.
«Vi ønsker å gjøre større screeninger i T-celler, monocytter og makrofager for å identifisere potensielle legemidler som kan virke på alle disse celletypene», sa Blanco. «Vi kan finne enda flere molekyler som ikke oppfører seg på en celletypespesifikk måte.»
