
Alt iLive-innhold blir gjennomgått med medisin eller faktisk kontrollert for å sikre så mye faktuell nøyaktighet som mulig.
Vi har strenge retningslinjer for innkjøp og kun kobling til anerkjente medieområder, akademiske forskningsinstitusjoner og, når det er mulig, medisinsk peer-evaluerte studier. Merk at tallene i parenteser ([1], [2], etc.) er klikkbare koblinger til disse studiene.
Hvis du føler at noe av innholdet vårt er unøyaktig, utdatert eller ellers tvilsomt, velg det og trykk Ctrl + Enter.
Derivater av talidomidforbindelser fører til at resistente kreftceller dør
Sist anmeldt: 02.07.2025
En studie utført av Goethe-universitetet i Frankfurt peker på muligheten for at thalidomidderivater potensielt kan brukes til å behandle kreft. Thalidomid ble solgt som en sovepille på 1950-tallet. Det ble senere beryktet for å forårsake alvorlige fødselsskader i de tidlige stadiene av svangerskapet.
Molekylet er også kjent for å markere proteiner i cellen for destruksjon. Som en del av den nåværende studien skapte forskere derivater av thalidomid. De var i stand til å vise at disse stoffene påvirker ødeleggelsen av proteiner som er ansvarlige for kreftcellers overlevelse.
Kanskje ingen andre molekyler har hatt en så turbulent fortid som thalidomid. Det var hovedingrediensen i et legemiddel som ble godkjent i mange land på 1950-tallet som beroligende middel og sovepille. Men det ble snart klart at gravide kvinner som tok thalidomid ofte fødte babyer med alvorlige misdannelser.
Men i de siste tiårene har medisinen igjen satt store forhåpninger til det. Studier har blant annet vist at det hemmer veksten av blodårer og derfor potensielt er egnet til å kutte ut svulster fra næringsmediet. Det viste seg også å være svært effektivt i behandlingen av myelomatose, ondartede svulster i beinmargen.
«Vi vet nå at thalidomid kan kalles et «molekylært lim»», forklarer dr. Xinglai Cheng ved Institutt for farmasøytisk kjemi ved Goethe-universitetet i Frankfurt. «Dette betyr at det er i stand til å gripe tak i to proteiner og sette dem sammen.»
Dette er spesielt interessant fordi et av disse proteinene er en slags «merkemaskin»: den fester en entydig «SØPPEL»-etikett til et annet protein.
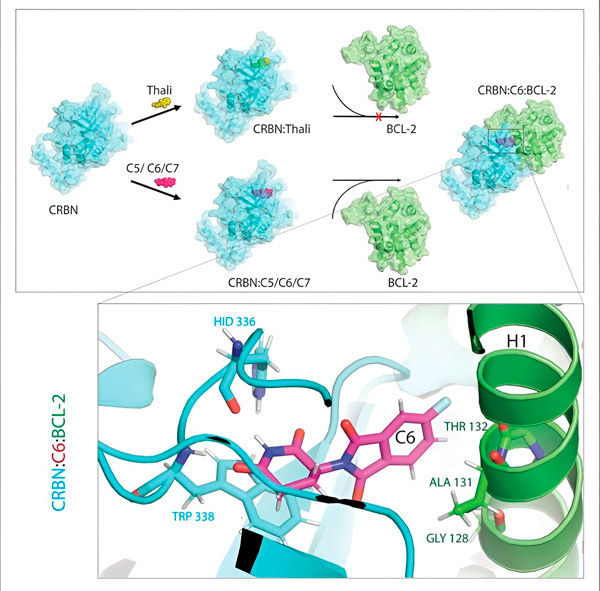
Thalidomidderivatene C5, C6 og C7 endrer CRBN, «merkingsmaskinen», slik at den kan binde seg til BCL-2. På denne måten merkes BCL-2-molekylet for nedbrytning – en mulig ny strategi for å bekjempe kreft. Forfatter: Dr. Xinglai Cheng.
Cellens avfallssystem gjenkjenner denne merkelappen: Den griper tak i det merkede proteinmolekylet og makulerer det. «Denne mekanismen forklarer de forskjellige effektene av thalidomid», sier Cheng. «Avhengig av hvilket protein som er merket, kan det forårsake deformiteter under embryonal utvikling eller ødelegge ondartede celler.»
Denne mekanismen åpner for store muligheter for medisin, siden kreftceller er avhengige av visse proteiner for å overleve. Hvis de systematisk kunne målrettes og makuleres, kunne kanskje sykdommen kureres. Problemet er at det molekylære limet er ganske særegent.
En av bindingspartnerne er alltid cellens merkemaskin, eller, i vitenskapelig språkbruk, en E3-ligase kalt CRBN. Bare noen få av de mange tusen proteinene i kroppen kan være den andre partneren – hvilke avhenger av limet.
«Så vi laget en serie thalidomidderivater», sier Cheng. «Vi testet deretter om de hadde klebende egenskaper, og i så fall hvilke proteiner de var effektive mot.» For å gjøre dette tilsatte forskerne derivatene sine til alle proteinene i den dyrkede cellelinjen. De observerte deretter hvilke av disse proteinene som ble degradert i nærvær av CRBN.
«I prosessen identifiserte vi tre derivater som kunne merke et cellulært protein som er svært viktig for nedbrytning, BCL-2», forklarer Cheng. «BCL-2 hindrer cellene i å aktivere sitt selvdestruksjonsprogram, så hvis det ikke er der, dør cellene.»
Derfor har BCL-2 lenge vært et fokus for kreftforskning. Det finnes til og med et leukemi-legemiddel kalt venetoklaks som reduserer effektiviteten til BCL-2 og dermed får muterte celler til å selvdestruere.
«I mange kreftceller er imidlertid BCL-2 i seg selv mutert. Som et resultat hemmer ikke venetoklaks lenger proteinet», sier Cheng. «Vi kunne vise at derivatene våre også markerer denne muterte formen for nedbrytning. I tillegg simulerte partnerne våre ved Max Planck-instituttet for biofysikk interaksjonen mellom thalidomidderivater og BCL-2 på en datamaskin. Dette viste at derivatene binder seg til helt andre steder enn venetoklaks – et resultat som vi senere kunne bekrefte eksperimentelt.»
Forskerne testet også forbindelsene sine på fruktfluer med kreftceller. Overlevelsesraten for fluene som ble behandlet på denne måten var betydelig høyere. Cheng advarer imidlertid mot å ha for store forhåpninger, ettersom disse resultatene fortsatt er grunnleggende forskning. «Selv om de viser at de modifiserte thalidomidmolekylene har et stort terapeutisk potensial, kan vi ennå ikke si om de vil vise seg å være effektive i praksis på et tidspunkt.»
Resultatene av studien ble publisert i tidsskriftet Cell Reports Physical Science.
